问题:
[单选] 中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备。下列关于这三个工业生产的描述正确的是()
电解法制金属钠时,负极反应式为Na++e-===Na。电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性。在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生。氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子。
问题:
[单选] 在一定温度下,用铂电极电解饱和硫酸钠溶液,对电解质溶液的判断正确的是()
不会有晶体析出。浓度变大。浓度变小。pH不变。
问题:
[单选] 用惰性电极电解NaCl和CuSO4混合溶液250mL,经过一段时间后两极均得到11.2L气体(标准状况下),则下列有关描述中,正确的是()
阳极发生的电极反应只有:4OH--4e-===2H2O+O2↑。两极得到的气体均为混合物气体。若Cu2+的起始浓度为1mol/L,则c(Cl-)起始浓度为2mol/L。Cu2+的起始浓度最大应小于4mol/L。
问题:
[单选] 目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是Pb-PbO2-H2SO4,下列关于该铅酸蓄电池的说法正确的是()
充电时,电源的正极接蓄电池标“+”的一极,电池上标有“-”的一极发生氧化反应。“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理。放电时在铅酸蓄电池的负极发生还原反应。若用此铅酸蓄电池电解饱和NaCl溶液,标况下制备1.12LCl2,电池内至少消耗H2SO40.10mol。
问题:
[单选] 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中,正确的是()
电池工作时,正极反应式为:O2+2H2O+4e-===4OH-。电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者。电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极。忽略能量损耗,当电池中消耗0.02gH2时,b极周围会产生0.04gH2。
问题:
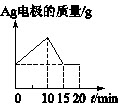
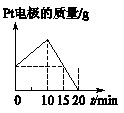
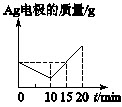
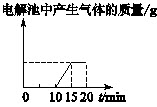
[单选] 将质量相等的Ag片和铂片插入硝酸银溶液(足量)中,银片与电源正极相连,铂片与电源负极相连。以电流1A通电10min,然后反接电源,以电流2A继续通电10min。下图为表示银电极的质量、铂电极的质量、电解池中产生气体的质量和电解时间的关系图,正确的是()
问题:
[填空题] 如图甲、乙是电化学实验装置。 (1)若甲、乙两烧杯中均盛有NaCl溶液。 ①甲中石墨棒上的电极反应式为(); ②乙中总反应的离子方程式为(); ③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为()。 (2)若甲、乙两烧杯中均盛有CuSO4溶液。 ①甲中铁棒上的电极反应式为(); ②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入()(填写物质的化学式)()g。
问题:
[问答题,简答题] 什么叫盐桥?为什么说它能消除液接电位?
 。
。 。
。 。
。 。
。